Desde
tiempos ancestrales la humanidad ha sabido de la importancia práctica
del calor y es por ello que ha dedicado grandes esfuerzos para tratar de
entender su naturaleza.
En este tema vamos a abordar el estudio del calor, su naturaleza, sus efectos, y su propagación. Además buscaremos la relación que guardan trabajo, energía y calor. De todo ello se encarga la termodinámica.
Para abordar cómodamente los contenidos de este tema te recomendamos que estés familiarizado con los conceptos de trabajo y energía. Matemáticamente, será suficiente con que te desenvuelvas con soltura con las operaciones aritméticas y algebraicas básicas.
a energía térmica es la energía interna que poseen los cuerpos debida a la agitación de las partículas que los componen. En este apartado veremos:
Así, las moléculas de hielo se encuentran unidas por fuerzas mayores
que las que hay en las moléculas de agua líquida. Estas a su vez, son
más fuertes que las fuerzas de unión entre moléculas de vapor de agua.
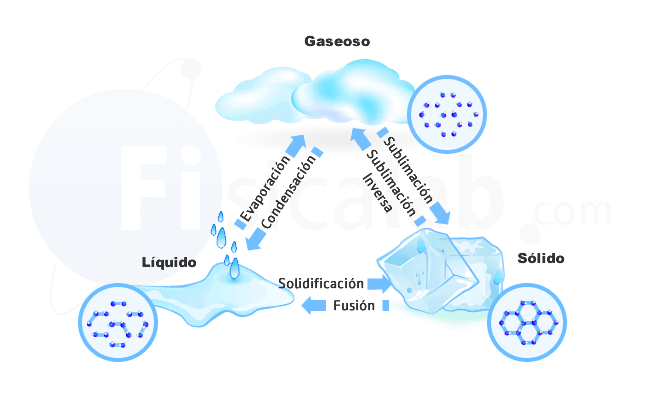
Los tres estados de agregación principales que se dan en la Naturaleza de forma habitual son:
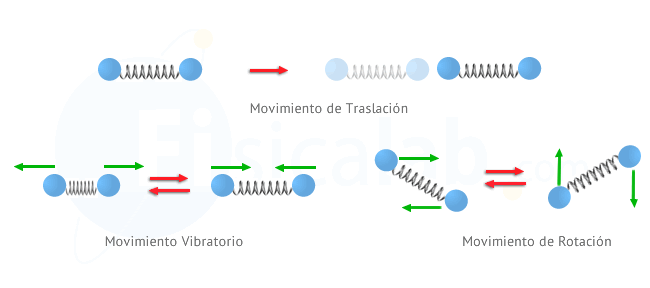
De modo general podemos distinguir 3 tipos de movimiento en las
partículas, responsables de la energía térmica. En la siguiente figura
se han representado un par de partículas realizando cada uno de ellos.
Observa que, para representar la fuerza de unión entre ellas se ha
utilizado un muelle ficticio.
La temperatura está relacionada con la sensación que experimentamos al tocar ciertos objetos. Esta sensación nos permite clasificarlos en objetos fríos, por ejemplo un cubito de hielo, y objetos calientes, por ejemplo una taza de café hirviendo. En este capítulo vamos a profundizar en qué se entiende en Física por temperatura. Explicaremos:
Observa que, a diferencia de lo que ocurre con otras magnitudes como
la velocidad o la aceleración, la temperatura no es una magnitud de tipo
mecánico, sino estadístico.
La distribución de velocidades de las partículas de un gas (y por tanto, la distribución de la energía cinética de cada partícula) , se rige por la ley de distribución de Maxwell. En la siguiente imagen puedes tener una idea cualitativa de qué efecto produce un aumento de temperatura en las moléculas de un gas.
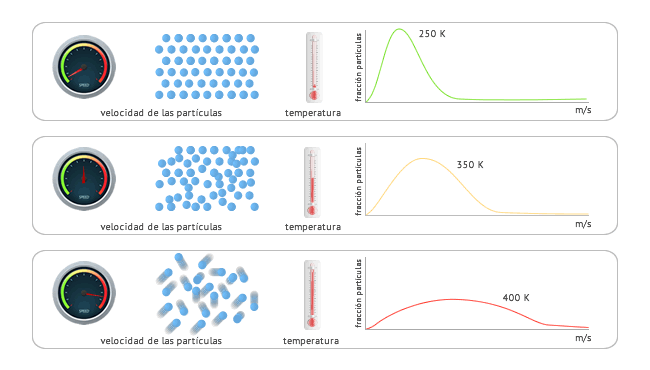 Para una misma sustancia cuanto mayor es la temperatura, mayor es la
velocidad de las partículas que la componen. De igual forma, en cada
gráfica puedes comprobar como cuanto mayor es la temperatura, mayor es
el rango de velocidades que pueden alcanzar debido a la distribución de
Maxwell. Por ejemplo, en la primera gráfica se puede observar como la
mayor parte de las partículas poseen velocidades bajas (sus valores se
concentran cercanos al origen de coordenadas) y a medida que sube la
temperatura, la concentración de la velocidad de las partículas se va
distendiendo.
Para una misma sustancia cuanto mayor es la temperatura, mayor es la
velocidad de las partículas que la componen. De igual forma, en cada
gráfica puedes comprobar como cuanto mayor es la temperatura, mayor es
el rango de velocidades que pueden alcanzar debido a la distribución de
Maxwell. Por ejemplo, en la primera gráfica se puede observar como la
mayor parte de las partículas poseen velocidades bajas (sus valores se
concentran cercanos al origen de coordenadas) y a medida que sube la
temperatura, la concentración de la velocidad de las partículas se va
distendiendo.
Por otro lado, cuando ponemos en contacto dos cuerpos, se produce un intercambio de energía térmica: la temperatura fluye desde el que tiene más temperatura hasta el que tiene menos. Si dejamos pasar el tiempo suficiente, ambas temperaturas se igualan. Así, cuando tocamos un cuerpo que está a menor temperatura que nosotros, tenemos una sensación térmica de frío y si está a mayor temperatura, de calor. La razón es, precisamente, dicho intercambio de energía térmica entre nuestro dedo y el cuerpo en cuestión.
Existen tres grandes escalas para medir la temperatura:
Punto triple del agua
El punto triple del agua es aquella pareja temperatura-presión en la que coexiste el agua en estado sólido, liquido y gaseoso. Concretamente la temperatura sería 0.01 ºC y la presión 611.73 Pa.
Proceso
Dado que asignamos el 0 K al cero absoluto, en la escala Kelvin no existen temperaturas negativas.
Dado que el tamaño de los grados es el mismo en la escala Kelvin y Celsius, un incremento de temperatura en grados Kelvin coincide con el incremento de grados centígrados.
La dilatación térmica es el proceso por el cual los cuerpos aumentan su volumen debido a su temperatura. Afecta a todos los estados de agregación de la materia. En este apartado veremos:
Cuando en lugar de aumentar, la temperatura disminuye, el volumen del cuerpo también lo hace, hablándose en estos casos de contracción térmica.
Estos fenómenos son especialmente importantes a la hora de fabricar determinadas estructuras como por ejemplo las vías de tren. Las industrias que fabrican los rieles los entregan con una longitud de unos 12 m. Es necesario unirlos (generalmente abulonados) para formar las vías. Durante el día la temperatura ambiente que pueden llegar a soportar ronda entorno a los 40° e incluso el acero puede alcanzar una temperatura muy superior. Dicha temperatura provoca dilataciones en las vías favoreciendo que en las uniones se provoquen deformaciones. Por esta razón, justamente en dichas uniones se deja una separación de unos 5 mm denominado junta de dilatación.
 El problema de esta separación es que es incompatible con el
desplazamiento de los trenes de alta velocidad (250 km/h) ya que generan
mucho ruido al circular el tren por ellas y las ruedas y rieles
sufrirían roturas. La tecnología moderna ha logrado soldaduras
especiales que absorben las dilataciones, por lo tanto hay tramos de
muchos kilómetros (varias decenas) sin separaciones aunque en las
cercanías de las estaciones de ferrocarril se siguen utilizando ya que
por esas zonas los trenes deben disminuir mucho su velocidad.
El problema de esta separación es que es incompatible con el
desplazamiento de los trenes de alta velocidad (250 km/h) ya que generan
mucho ruido al circular el tren por ellas y las ruedas y rieles
sufrirían roturas. La tecnología moderna ha logrado soldaduras
especiales que absorben las dilataciones, por lo tanto hay tramos de
muchos kilómetros (varias decenas) sin separaciones aunque en las
cercanías de las estaciones de ferrocarril se siguen utilizando ya que
por esas zonas los trenes deben disminuir mucho su velocidad.
Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvin, por comodidad también se usa el ºC, en cuyo caso el coeficiente de dilatación lineal λ se expresa en ºC-1, aunque su valor es el mismo

La relación entre el coeficiente de dilatación lineal λ y el coeficiente de dilatación superficial σ es σ=2⋅λ .
 Observa que, aunque la unidad de temperatura en el Sistema
Internacional es el kelvin, por comodidad también se usa el ºC, en cuyo
caso el coeficiente de dilatación superficial σ se expresa en ºC-1, aunque su valor es el mismo.
Observa que, aunque la unidad de temperatura en el Sistema
Internacional es el kelvin, por comodidad también se usa el ºC, en cuyo
caso el coeficiente de dilatación superficial σ se expresa en ºC-1, aunque su valor es el mismo.
La relación entre el coeficiente de dilatanción lineal λ y el coeficiente de dilatación volumétrico γ es γ=3⋅λ
 Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvin, por comodidad también se usa el ºC, en cuyo caso el coeficiente de dilatación volumétrico γ se expresa en ºC-1, aunque su valor es el mismo.
Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvin, por comodidad también se usa el ºC, en cuyo caso el coeficiente de dilatación volumétrico γ se expresa en ºC-1, aunque su valor es el mismo.
El efecto de la dilatación en los líquidos es más evidente que en los sólidos: al encontrarse sus moléculas con más libertad para moverse, el volumen que ocupa cada una aumenta más facilmente con la temperatura, por lo que también lo hace el volumen del líquido en su conjunto. Su expresión es similar a la dilatación volumétrica de los sólidos.
Observa que, aunque la unidad de temperatura en el Sistema Internacional es el kelvin K, por comodidad también se usa el grado centígrado ºC, en cuyo caso el coeficiente de dilatación del líquido α se expresa en ºC-1, aunque su valor es el mismo.
Ten muy presente que cuando queremos medir la dilatación en un líquido, hemos de tener en cuenta que el recipiente sólido en el que lo colocamos también se dilata.
Observa que, aunque la unidad de temperatura en el Sistema
Internacional es el kelvín, por comodidad también se usa el ºC, en cuyo
caso el coeficiente de dilatación del gas α se expresa en ºC-1, aunque su valor es el mismo.
Observa también que el coeficiente de dilatación αp es igual para todos los gases que se encuentran a una determinada presión. Por otro lado, el volumen V de un gas es 0 a una temperatura T de -273 ºC (0 K o cero absoluto). Este comportamiente permite dibujar las siguientes lineas que representan el volumen de cualquier gas a una determinada presión.
 Finalmente, si conoces el volumen inicial del gas a 0 ºC, V0 , el coeficiente de dilatación de cualquier gas viene dado por:
Finalmente, si conoces el volumen inicial del gas a 0 ºC, V0 , el coeficiente de dilatación de cualquier gas viene dado por:
αp=1273.15 ºC−1
P⋅V=n⋅R⋅T
Donde n es el número de moles del gas y R es una constante de valor 0.982 atm·L / K·mol.
Si consideramos un gas a presión constante sometido a dos temperaturas T0 y T1 distintas, ocupara dos volúmenes distintos, V0 y V1. Dado que la presión es constante, P1 = P2 = P y podemos escribir:
P⋅V0=n⋅R⋅T0P⋅V1=n⋅R⋅T1
Por tanto, la diferencia entre ambas expresiones nos permite llegar al resultado buscado:
P⋅V1−P⋅V0=n⋅R⋅(T1−T0)⇒P⋅(V1−V0)=n⋅R⋅(T1−T0)⇒⇒V1−V0=n⋅RP⋅(∆T)⇒V1=V0+n⋅RP⋅(∆T)=V0⋅(1+n⋅RP⋅V0⋅(∆T))⇒⇒V1=[1]V0⋅(1+n⋅Rn⋅R⋅T0⋅(∆T))=V0⋅(1+1T0⋅(∆T))
[1] P⋅V0=n⋅R⋅T0
Finalmente, identificando la expresión anterior con la que habíamos dado para la dilatación volumétrica de los gases, V=V0⋅(1+αp⋅∆T) tenemos que αp = 1/T0 y, dado que habíamos dicho que T0 = 273.15 ºC, αp = 1/273.15 ºC-1.
CALOR:
El calor es el proceso a través del cual se transfiere energía térmica entre los cuerpos. En este apartado estudiaremos

Puedes entender la capacidad calorífica como la dificultad con que un cuerpo aumenta su temperatura cuando le suministramos una determinada cantidad de calor. Así, a mayor capacidad calorífica, menor incremento de temperatura para una determinada cantidad de calor suministrado. Los aislantes térmicos tienen una capacida calorífica alta.
c=Cn
Donde n en este caso es el número de moles. En cuanto a las unidades de medida del calor específico molar, se suele utilizar el J/mol·K aunque también se usa con frecuencia el cal/mol·ºC.

Puedes entender la capacidad calorífica como la dificultad con que un cuerpo aumenta su temperatura cuando le suministramos una determinada cantidad de calor. Así, a mayor capacidad calorífica, menor incremento de temperatura para una determinada cantidad de calor suministrado. Los aislantes térmicos tienen una capacida calorífica alta.
c=Cn
Donde n en este caso es el número de moles. En cuanto a las unidades de medida del calor específico molar, se suele utilizar el J/mol·K aunque también se usa con frecuencia el cal/mol·ºC.

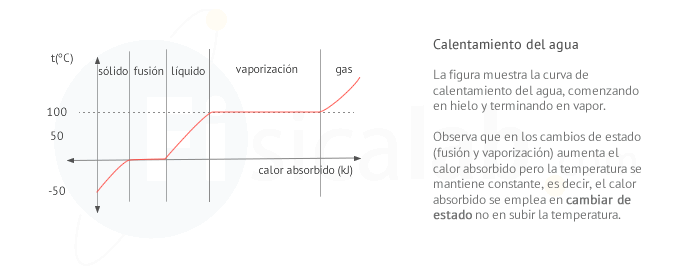 La variación de entalpía o calor latente L es una característica de cada sustancia para cada cambio de estado. Así, por ejemplo, la fusión de 1 gramo de hielo a 0 ºC y a 1 atm consume 335 J de calor, por lo que Lfusión = 335 J/kg . Como puedes suponer, cuando 1 gramo de agua a 0 ºC y a 1 atm se convierte en hielo, se liberan exactamente 335 J.
La variación de entalpía o calor latente L es una característica de cada sustancia para cada cambio de estado. Así, por ejemplo, la fusión de 1 gramo de hielo a 0 ºC y a 1 atm consume 335 J de calor, por lo que Lfusión = 335 J/kg . Como puedes suponer, cuando 1 gramo de agua a 0 ºC y a 1 atm se convierte en hielo, se liberan exactamente 335 J.
QA=−QB⇒mA⋅cA⋅(T−TA)=−mB⋅cB⋅(T−TB)⇒mA⋅cA⋅(T−TA)=mB⋅cB⋅(TB−T)



La termodinámica es la parte de la física que se encarga de la relación entre el calor y el trabajo. En este apartado estudiaremos:
Esta relación entre trabajo y calor, que hoy vemos de manera clara,
no lo fue hasta el S. XIX. El estudio del trabajo y del calor eran
disciplinas separadas: la mecánica y la termología respectivamente. Así también las unidades en que se medían cada uno, julio y caloría.
A mediados del S. XIX el científico inglés James Prescott Joule diseñó
un dispositivo capaz de medir el equivalente mecánico del calor,
estableciendo, así, la equivalencia señalada.
Tiene las siguientes características:
Recuerda que un gas ideal no es más que un gas teórico
en el que sus partículas, con desplazamiento aleatorio, no interactúan
entre sí. La mayoría de los gases reales, a temperaturas relativamente
altas y presiones pequeñas pueden considerarse gases ideales y por tanto
podemos aplicar esta expresión como su ecuación de estado en los
ejercicios de este tema.
Finalmente, decimos que un sistema ha alcanzado el estado de equilibrio cuando sus variables de estado permanecen constantes. Todas las propiedades del sistema en equilibrio quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas. La termodinámica sólo se ocupa de sistemas en estado de equilibrio.
En este tema vamos a abordar el estudio del calor, su naturaleza, sus efectos, y su propagación. Además buscaremos la relación que guardan trabajo, energía y calor. De todo ello se encarga la termodinámica.
Para abordar cómodamente los contenidos de este tema te recomendamos que estés familiarizado con los conceptos de trabajo y energía. Matemáticamente, será suficiente con que te desenvuelvas con soltura con las operaciones aritméticas y algebraicas básicas.
a energía térmica es la energía interna que poseen los cuerpos debida a la agitación de las partículas que los componen. En este apartado veremos:
- Cuáles son los principales estados de agregación de la materia
- Qué explica la teoría cinético molecular de la materia
- El concepto de energía térmica
Estados de agregación de la materia
¿Recuerdas la primera vez que pusiste agua líquida en una congelador, y salió convertida en hielo? ¿Has puesto alguna vez agua a hervir en una candela? Se trata de dos ejemplos en los que el estado de la materia cambia, pero no su composición. El hielo, el agua líquida y el vapor de agua son diferentes estados de agregación del agua. Cuando pasamos de uno a otro se dice que se ha producido un cambio de estado.
La materia del Universo se presenta en distintos estados de agregación, según sus condiciones de temperatura y presión. Cada estado de agregación presenta propiedades físicas comunes, relacionadas con las fuerzas de unión entre las partículas (moléculas, iones, etc) de la sustancia. Se puede provocar un cambio de estado en una sustancia modificando su temperatura y/o su presión.
Los tres estados de agregación principales que se dan en la Naturaleza de forma habitual son:
- Sólido: Las fuerzas que unen las partículas son bastante intensas por lo que estas se encuentran en posiciones fijas, ordenadas y próximas entre sí. Las partículas solamente tienen movimientos de vibración en torno a dichas posiciones fijas
- Líquido: Las fuerzas de unión son más débiles que en los sólidos. Las partículas pueden desplazarse de un punto a otro dentro del líquido, pero se encuentran juntas
- Gaseoso: Las fuerzas de unión entre las partículas son prácticamente despreciables por lo que el desorden es total. Existe mucho espacio vacío entre partículas, tienen libertad absoluta de movimiento (movimientos de vibración, de traslación y de rotación) y la velocidad de las partículas se explica por la ley de distribución de Maxwell

Teoría cinética de la materia
La teoría cinética de la materia, también conocida como teoría cinético molecular de la materia, explica los estados de agregación a través de los siguientes supuestos:- La materia está constituida por partículas microscópicas en continuo movimiento
- El tamaño de las partículas es mucho menor que la distancia que existe entre ellas
- Las partículas se mueven en todas direcciones con una velocidad media que varía según el estado físico. En los gases la velocidad de traslación es grande y en los sólidos sólo hay movimiento de vibración.
- Un incremento en la temperatura origina un incremento en la energía de las partículas
Energía Térmica
Los partículas presentes en la materia cuentan con energía cinética y energía potencial (fundamentalmente energía potencial elástica) asociadas a su movimiento. Dichas energías son responsables de la energía térmica.
La energía térmica es la que poseen los cuerpo debido al movimiento interno de las partículas (moléculas, iones, átomos).

La temperatura está relacionada con la sensación que experimentamos al tocar ciertos objetos. Esta sensación nos permite clasificarlos en objetos fríos, por ejemplo un cubito de hielo, y objetos calientes, por ejemplo una taza de café hirviendo. En este capítulo vamos a profundizar en qué se entiende en Física por temperatura. Explicaremos:
- El concepto de temperatura
- En qué consisten los termómetros
- Cuáles son las escalas de temperatura más habituales
- Cómo realizar la conversión entre las distintas escalas de temperatura
- Qué es el cero absoluto
Concepto de temperatura
La temperatura nos permite conocer el nivel de energía térmica con que cuenta un cuerpo. Las partículas que poseen los cuerpos se mueven a una determinada velocidad, por lo que cada una cuenta con una determinada energía cinética. El valor medio de dicha energía cinética <Ec> está directamente relacionado con la temperatura del cuerpo. Así, a mayor energía cinética media de las partículas, mayor temperatura y a menor energía cinética media, menor temperatura.
La temperatura es una
magnitud escalar que mide la cantidad de energía térmica que tiene un
cuerpo. En el caso de los gases su valor es proporcional a la energía
cinética media de las moléculas, según la expresión:
Donde:
Donde:
- Temperatura T: Su unidad de medida en el Sistema Internacional es el Kelvín ( K )
- Constante universal k: Se trata de una constante igual para todos los gases. Su unidad de medida en el Sistema Internacional es el Kelvín partido Julio ( K/J )
- Energía cinética promedio de las moléculas del gas <Ec>: Se trata del valor medio de energía cinética de las moléculas del gas. Su unidad de medida en el Sistema Internacional es el Julio ( J )
La distribución de velocidades de las partículas de un gas (y por tanto, la distribución de la energía cinética de cada partícula) , se rige por la ley de distribución de Maxwell. En la siguiente imagen puedes tener una idea cualitativa de qué efecto produce un aumento de temperatura en las moléculas de un gas.

Por otro lado, cuando ponemos en contacto dos cuerpos, se produce un intercambio de energía térmica: la temperatura fluye desde el que tiene más temperatura hasta el que tiene menos. Si dejamos pasar el tiempo suficiente, ambas temperaturas se igualan. Así, cuando tocamos un cuerpo que está a menor temperatura que nosotros, tenemos una sensación térmica de frío y si está a mayor temperatura, de calor. La razón es, precisamente, dicho intercambio de energía térmica entre nuestro dedo y el cuerpo en cuestión.
¿Cómo medimos la temperatura?
La temperatura es una magnitud estadística, por lo que no podemos medirla directamente. Para medirla hacemos uso de diversas magnitudes que varían con ella, como por ejemplo la altura de una columna de mercurio, la resistencia eléctrica o el volumen y la presión de un gas. A estas magnitudes, se las denomina magnitudes termométricas.
Para medir la temperatura usamos los termómetros. Un termómetro es un dispositivo que nos permite conectar alguna magnitud termométrica con la temperatura.
Tipos de termómetros
Existen distintos tipos de termómetros según la magnitud física que se mide y que varía al variar la temperatura. En la siguiente lista tienes algunos de los principales. En cursiva aparece el nombre de los termómetros y una breve descripción.- Basados en dilatación
- Gases
- Cambio de volumen: Termómetro de gas a presión constante. El volumen del gas varía con la temperatura. Son muy exactos y generalmente son utilizados para la calibración de otros termómetros
- Cambio de presión: Termómetro de gas a volumen constante. La presión del gas varía con la temperatura. Son muy exactos y generalmente son utilizados para la calibración de otros termómetros
- Líquidos
- Columna de mercurio: Termómetro de mercurio. La altura de la columna de mercurio varía con la temperatura. Su comercialización y uso está prohibido en algunos países como España
- Columna de alcohol coloreado: Termómetro de alcohol. La altura de la columna de alcohol teñido varía con la temperatura. Fue el primero que se creó
- Sólidos
- Cambio de longitud: Termómetro bimetálico. Consiste en dos placas de diferentes metales unidas rigidamente. El conjunto se dobla en arco de manera proporcional al cambio de temperatura. Esto se debe a que cada placa tiene un coeficiente de dilatación distinto y los cambios de temperatura provocan cambios distintos en sus longitudes
- Gases
- Basados en propiedades eléctricas
- Resistencia
- Semiconductor: Termistor. Los semiconductores son materiales que se comportan como conductores o aislantes según la temperatura a la que se encuentren. Esto los convierte en dispositivos que permiten medir la temperatura
- Platino: Termómetro de platino. La resistencia eléctrica del platino varía con la temperatura de forma lineal
- Efecto termoeléctrico
- Termopar: Se trata de un par empalmes (soldaduras) de dos alambres conductores de metales distintos. Uno de los empalmes se mantiene a una temperatura constante de referencia. La fuerza electromotriz generada depende de la diferencia de temperaturas entre las soldaduras
- Resistencia
- Basados en radiación térmica
- Radiación infrarroja
- Termómetro infrarrojo: Los cuerpos calientes emiten calor en forma de radiaciones electromagnéticas, captada por este tipo de termómetros
- Luz visible
- Pirómetro óptico: Son normalmente utilizados para medir temperaturas superiores a 700 ºC. Se basan en el cambio del color con el que brillan los objetos calientes. Desde el rojo oscuro al amarillo, llegando casi al blanco a unos 1300º C
- Radiación infrarroja
Escalas de temperatura
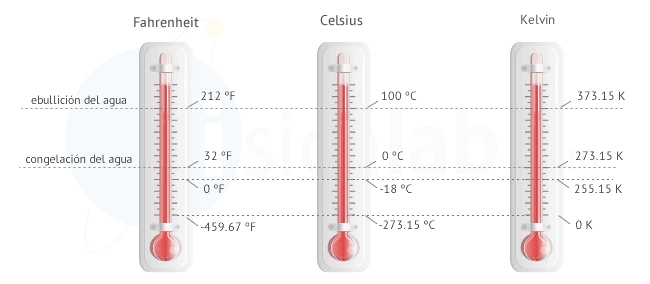
La temperatura se mide indirectamente a través de las magnitudes termométricas. Como vamos a ver, usaremos los valores de estas magnitudes en ciertos estados fijos para calibrar los termómetros, estableciendo, así, una escala. Ejemplos de estos estados fijos son la congelación o la ebullición del agua.Existen tres grandes escalas para medir la temperatura:
- Celsius
- Farenheit
- Kelvin
Escala centígrada o Celsius
- Se asigna el valor 0 del termómetro al punto normal de congelación del agua
- Se asigna el valor 100 del termómetro al punto normal de ebullición del agua
- Dicho intervalo se divide en 100 partes iguales. Cada una de ellas se denomina grado Celsius ( ºC )
Escala Fahrenheit
- Se asigna el valor 32 del termómetro al punto normal de congelación del agua
- Se asigna el valor 212 del termómetro al punto normal de ebullición del agua
- Dicho intervalo se divide en 180 partes iguales. Cada una de ellas se denomina grado Fahrenheit ( ºF )
Escala Kelvin, absoluta o Kelvin
Es la escala usada en el Sistema Internacional de Unidades. Para definir la escala absoluta vamos a definir primeramente el cero absoluto de temperatura y el punto triple del agua.Cero absoluto de temperatura
Es el estado de mínima temperatura que puede tener un cuerpo. En él, el movimiento de los átomos y moléculas que componen el cuerpo sería nulo. Es una temperatura teórica que no puede alcanzarse en la práctica.Punto triple del agua
El punto triple del agua es aquella pareja temperatura-presión en la que coexiste el agua en estado sólido, liquido y gaseoso. Concretamente la temperatura sería 0.01 ºC y la presión 611.73 Pa.
Proceso
- Se asigna el valor 0 del termómetro a la temperatura más baja que puede existir, el cero absoluto
- Se asigna el valor 273.16 al punto triple del agua
- Se hace coincidir el tamaño de los grados Kelvin con los Grados Celsius
El Kelvin es la unidad de temperatura usada en el Sistema Internacional de Unidades.
Dado que el tamaño de los grados es el mismo en la escala Kelvin y Celsius, un incremento de temperatura en grados Kelvin coincide con el incremento de grados centígrados.
Conversión de escalas
Tendiendo en cuenta que tC, tF y T es la temperatura expresada en grados centígrados, Fahrenheit y Kelvin respectivamente, usaremos las siguientes expresiones para convertir entre escalas.-
Conversión entre Celsius y Farenheit
tC−0100=tF−32180⇒tC5=tF−329 -
Conversión entre Celsius y Kelvin
El cero absoluto corresponde con -273.15 º C
-
Conversión entre Farenheit y Kelvin
El cero absoluto corresponde con -459.67 º F

La dilatación térmica es el proceso por el cual los cuerpos aumentan su volumen debido a su temperatura. Afecta a todos los estados de agregación de la materia. En este apartado veremos:
- El concepto de dilatación y contracción térmica
- La dilatación en los sólidos
- La dilatación en los líquidos
- La dilatación en los gases
¿Por qué se dilatan los cuerpos?
Cuando un cuerpo aumenta su temperatura, las partículas se mueven más deprisa, por lo que necesitan más espacio para desplazarse. Es por ello que el cuerpo necesita aumentar su volumen.
La dilatación térmica es el proceso por el cual los cuerpos aumentan su volumen cuando se aumenta su temperatura.
Estos fenómenos son especialmente importantes a la hora de fabricar determinadas estructuras como por ejemplo las vías de tren. Las industrias que fabrican los rieles los entregan con una longitud de unos 12 m. Es necesario unirlos (generalmente abulonados) para formar las vías. Durante el día la temperatura ambiente que pueden llegar a soportar ronda entorno a los 40° e incluso el acero puede alcanzar una temperatura muy superior. Dicha temperatura provoca dilataciones en las vías favoreciendo que en las uniones se provoquen deformaciones. Por esta razón, justamente en dichas uniones se deja una separación de unos 5 mm denominado junta de dilatación.

Dilatación de sólidos
De entre los estados de agregación de la materia estudiados, el estado sólido es el que tiene las fuerzas de cohesión más fuertes, por lo que resulta más dificil observar la dilatación que en líquidos y gases. En función del número de dimensiones que predominan en el cuerpo, podemos distinguir tres casos:Dilatación lineal
Se produce cuando predomina una dimensión frente a las otras dos. Ejemplos de cuerpos que se dilatan linealmente son: varillas, alhambres, barras...
La dilatación lineal de un cuerpo viene dada por la expresión:
Donde:
Donde:
- l, l0 : Longitud final e inicial respectivamente del cuerpo. Su unidad de medida en el Sistema Internacional es el metro ( m )
- λ: Coeficiente de dilatación lineal. Es específico de cada material y representa el alargamiento que experimenta la unidad de longitud de un sólido, cuando su temperatura se eleva 1 K. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el cuerpo. Su unidad de medida en el Sistema Internacional es el kelvin ( K ), aunque también se usa el ºC

Valores típicos del coeficiente de dilatación
El coeficiente de dilatación en el caso de los líquidos suele mantenerse constante para cambios de temperatura ∆T menores de 100 grados. Algunos valores típicos para el coeficiente de dilatación lineal son:| Material | Coeficiente dilatación lineal λ ( K-1 o ºC-1 ) |
|---|---|
| Plata | 3·10-5 |
| Plomo | 2.9·10-5 |
| Zinc | 2.6·10-5 |
| Aluminio | 2.4·10-5 |
| Cobre | 1.7·10-5 |
| Oro | 1.5·10-5 |
| Vidrio | 0.9·10-5 |
| Diamante | 0.12·10-5 |
| Cuarzo | 0.04·10-5 |
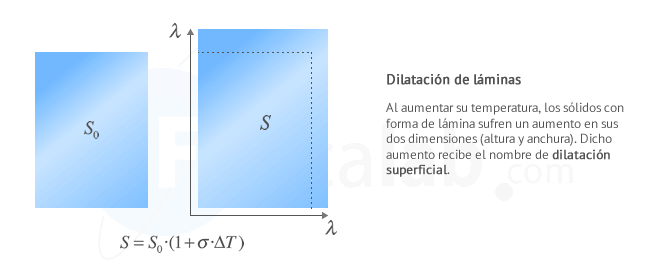
Dilatación superficial
Se produce cuando predominan dos dimensiones (una superficie) frente a una tercera. Ejemplos de cuerpos que se dilatan superficialmente son: láminas, planchas...
La dilatación superficial de un cuerpo viene dada por la expresión:
Donde:
Donde:
- S, S0 : Área final e inicial respectivamente del cuerpo. Su unidad de medida en el Sistema Internacional es el metro al cuadrado ( m2 )
- σ: Coeficiente de dilatación superficial. Es específico de cada material y representa el aumento de superficie de un sólido de área unidad, cuando su temperatura se eleva 1 K. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el cuerpo. Su unidad de medida en el Sistema Internacional es el kelvin ( K ) , aunque también se usa el ºC

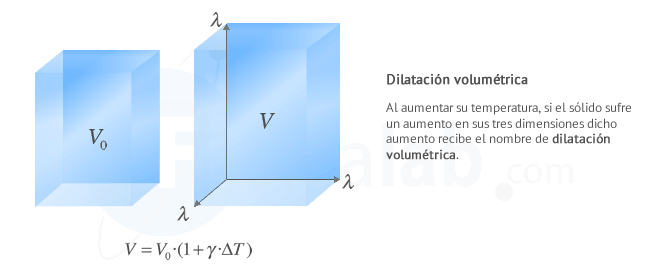
Dilatación volumétrica o cúbica
Se produce cuando las tres dimensiones del cuerpo son igualmente relevantes. Ejemplos de cuerpos que se dilatan de modo volumétrico son: los dados del parchís, o las estatuas de los jardines ...
La dilatación volumétrica de un cuerpo viene dada por la expresión:
Donde:
Donde:
- V, V0 : Volumen final e inicial respectivamente del cuerpo. Su unidad de medida en el Sistema Internacional es el metro al cubo ( m3 )
- γ: Coeficiente de dilatación volumétrica o cúbica. Es específico de cada material y representa el aumento de volumen de un sólido de volumen unidad, cuando su temperatura se eleva 1 K. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el cuerpo. Su unidad de medida en el Sistema Internacional es el kelvin ( K ), aunque también se usa el ºC

El efecto de la dilatación en los líquidos es más evidente que en los sólidos: al encontrarse sus moléculas con más libertad para moverse, el volumen que ocupa cada una aumenta más facilmente con la temperatura, por lo que también lo hace el volumen del líquido en su conjunto. Su expresión es similar a la dilatación volumétrica de los sólidos.
La dilatación de los líquidos sigue la expresión:
Donde:
Donde:
- V, V0 : Volumen final e inicial respectivamente del líquido. Su unidad de medida en el Sistema Internacional es el metro al cubo ( m3 )
- α: Coeficiente de dilatación del líquido. Es específico de cada líquido y representa el aumento de volumen de un líquido de volumen la unidad, cuando su temperatura se eleva 1 K. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el líquido. Su unidad de medida en el Sistema Internacional es el kelvin ( K ), aunque también se usa el ºC
Ten muy presente que cuando queremos medir la dilatación en un líquido, hemos de tener en cuenta que el recipiente sólido en el que lo colocamos también se dilata.
Valores típicos del coeficiente de dilatación
El coeficiente de dilatación en el caso de los líquidos suele variar con la temperatura de forma más pronunciada a lo que ocurre en los sólidos. A continuación se recogen algunos valores típicos del coeficiente de dilatación α para líquidos a una temperatura de 20 ºC. Observa que son sensiblemente superiores al caso de los sólidos. Esto implica que la dilatación en los líquidos es más evidente que en los sólidos para un mismo material y un mismo cambio de temperatura.| Material | Coeficiente dilatación α ( K-1 o ºC-1 ) |
|---|---|
| Mercurio | 18.1·10-4 |
| Alcohol | 14·10-4 |
| Benceno | 11.7·10-4 |
| Glicerina | 5.2·10-4 |
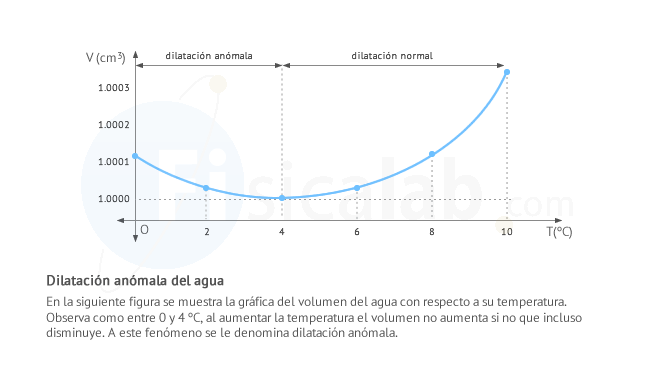
Dilatación anómala del agua
Algunos líquidos se comportan de manera anómala en ciertos intervalos de temperatura y presión, aumentando su volumen cuando disminuye su temperatura y viceversa. Es el caso del agua a 1 atm de presión y en el intervalo de 0 ºC a 4 ºC. Este comportamiento es muy importante para que pueda existir la vida.
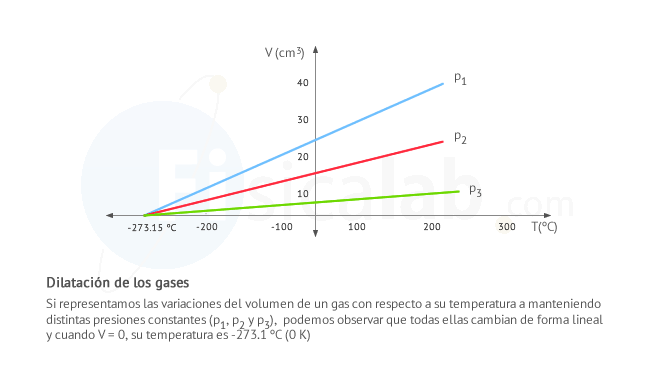
Dilatación de gases
El efecto de la dilatación en los gases es el más evidente de todos. Los gases varian de forma clara su volumen tanto con la temperatura como con la presión debido a que las fuerzas de cohesión entre las partículas son más debiles que en los casos anteriores. Su expresión es similar a la dilatación volumétrica de los sólidos.
La dilatación de los gases a presión constante sigue la expresión:
Donde:
Donde:
- V, V0 : Volumen final e inicial respectivamente del líquido. Su unidad de medida en el Sistema Internacional es el metro al cubo ( m3 )
- αp: Coeficiente de dilatación a presión constante. Para una presión determinada existe un valor de αp , único igual para todos los gases. Su unidad de medida en el Sistema Internacional es el K-1, aunque también se usa el ºC-1
- ∆T: Incremento de temperatura que experimenta el líquido. Su unidad de medida en el Sistema Internacional es el kelvin ( K ), aunque también se usa el ºC
Observa también que el coeficiente de dilatación αp es igual para todos los gases que se encuentran a una determinada presión. Por otro lado, el volumen V de un gas es 0 a una temperatura T de -273 ºC (0 K o cero absoluto). Este comportamiente permite dibujar las siguientes lineas que representan el volumen de cualquier gas a una determinada presión.

Comprobación
La ecuación general de los gases establece que el producto de la presión P por el volumen V que ocupa el gas se relaciona con la temperatura T según:Si consideramos un gas a presión constante sometido a dos temperaturas T0 y T1 distintas, ocupara dos volúmenes distintos, V0 y V1. Dado que la presión es constante, P1 = P2 = P y podemos escribir:
CALOR:
El calor es el proceso a través del cual se transfiere energía térmica entre los cuerpos. En este apartado estudiaremos
- Qué es el calor
- Cómo se relaciona el calor con el cambio de temperatura a través de:
- Cómo se relaciona el calor con los cambios en el estado de agregación
- Qué ocurre cuando dos cuerpos a distinta temperatura se ponen en contacto
- Los mecanismos de propagación del calor
Concepto de calor
Las partículas de los cuerpos no están en reposo sino que se encuentran en constante agitación. Como consecuencia de esta agitación, los cuerpos poseen una determinada energía térmica. La temperatura es un indicador de la energía térmica que tienen los cuerpos. De modo general podemos decir que, a mayor temperatura, mayor energía térmica. Pues bien, los cuerpos y los sistemas pueden intercambiar energía térmica. A esta energía térmica intercambiada se le denomina calor. En ocasiones también se denomina calor al propio proceso de transferencia de energía.
El calor es la energía intercambiada entre un cuerpo y su entorno por el hecho de encontrarse a distinta temperatura. El calor, como el trabajo, es energía en tránsito, por lo que se puede entender también como un método para transferir energía.
¿Es lo mismo calor que temperatura?
No, calor y temperatura no son la misma cosa. Es muy posible que esta idea te parezca extraña porque cotidianamente la solemos confundir. Sin embargo te proponemos el siguiente experimento.- Llena dos ollas de agua, una con la mitad o la tercera parte de agua que la otra
- Ponlas ambas sobre una llama de igual intensidad. Anota el tiempo que tarda cada una de ellas en empezar a hervir
- Mide la temperatura de cada una en el momento en que empiezan a hervir
- La que tiene menos agua empieza a hervir antes, o lo que es lo mismo, ha necesitado menos energía para llegar al punto de ebullición.
- Si mides la temperatura al comenzar a hervir en los dos casos, ambas temperaturas son iguales (en torno a 100 ºC).

Capacidad calorífica
Cuando colocas aceite en una sartén y enciendes el fuego, el aceite comenzará a aumentar su temperatura. En general, cuando suministramos calor a un cuerpo este puede aumentar su temperatura.
La capacidad calorífica de
un cuerpo es la relación que hay entre el calor suministrado al cuerpo y
su incremento de temperatura. Se puede calcular a través de la
expresión:
Donde:
Donde:
- C : Capacidad calorífica. Es la cantidad de calor que el cuerpo tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kelvín ( J/K ), aunque también se usa con frecuencia la caloría por grado centígrado ( cal/ºC )
- Q : Calor intercambiado. Cantidad de energía térmica intercambiada con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se usa con frecuencia la caloría ( cal ). 1 cal = 4.184 J
- ∆T : Variación de temperatura. Viene determinada por la diferencia entre la temperatura inicial y la final ∆T = Tf -Ti . Su unidad de medida en el Sistema Internacional es el kelvín ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC )
¿De qué depende la capacidad calorífica?
La capacidad calorífica de un cuerpo depende de dos factores:- La sustancia por la que está formado el cuerpo: No aumentan su temperatura de igual manera un gramo de agua que un gramo de aceite o un gramo de hierro, aún cuando se sitúen sobre un fuego de igual intensidad: El hierro sería el primero en aumentar su temperatura, seguido del aceite y finalmente el agua
- La cantidad de masa del cuerpo: Tal y como has podido comprobar en el experimento anterior, no aumenta su temperatura de igual manera un gramo y un kilogramo de agua, aún cuando se sitúen sobre un fuego de igual intensidad: un gramo de agua variará su temperatura más rapidamente que un kilogramo de esta misma sustancia
Calor específico
El calor específico se obtiene a partir de la capacidad calorífica y representa la dificultad con que una sustancia intercambia calor con el entorno. Es una característica de las sustancias que forman los cuerpos y es independiente de la masa.
El calor específico de una sustancia es su capacidad calorífica por unidad de masa. Viene dada por la expresión:
Donde:
Donde:
- c : Calor específico. Es la cantidad de calor que la unidad de masa de la sustancia tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC )
- C : Capacidad calorífica. Es la cantidad de calor que el cuerpo tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kelvín ( J/K ), aunque también se usa con frecuencia la caloría por grado centígrado ( cal/ºC )
- m: Masa. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
Calor específico molar
En ocasiones, particularmente en el caso de sustancias gaseosas, conviene usar el mol como unidad de masa. De esta manera, el calor específico queda referido a la unidad de masa según la expresión:Características del calor específico
Algunas características del calor específico son:- Cuanto mayor es el calor específico de una sustancia, más calor hay que intercambiar para conseguir variar su temperatura
- Existe un rango de temperaturas dentro del cual el calor específico es constante. Aunque a la hora de resolver los ejercicios de este nivel se considera c constante, en realidad el calor específico de cualquier sustancia varía con la temperatura
- Según si el proceso de intercambio de energía (calor) tiene lugar a presión constante o a volumen constante se habla de calor específico a presión constante cp o calor específico a volumen constante cv. Si no se especifica, el proceso se supone a presión constante de 1 atm
- Normalmente en sólidos y líquidos cp ≈ cv
- Normalmente en gases cp ≠ cv
Ecuación fundamental de la termología
Gracias al concepto de calor específico disponemos de una expresión para determinar el calor agregado o extraido de una sustancia a partir del incremento en su temperatura, su calor específico y la cantidad de masa que tenemos. A esta expresión se la conoce como la ecuación fundamental de la termología.
La ecuación fundamental de la termología
establece la relación entre el incremento de temperatura experimentado
por una determinada cantidad de sustancia y el calor que intercambia:
Donde:
Donde:
- Q : Calor intercambiado. Cantidad de energía térmica intercambiada con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se usa con frecuencia la caloría ( cal ). 1 cal = 4.184 J
- m : Masa. Cantidad de sustancia considerada. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- c : Calor específico. Representa la facilidad que una sustancia tiene para variar su temperatura cuando intercambia calor con el entorno. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC ). Cuando conocemos el número de moles de sustancia en lugar de su peso (nos dan m en moles), podemos usar el calor específico molar que se suele específicar en J/mol·K ó cal/g·ºC
- ∆T : Variación de temperatura. Viene determinada por la diferencia entre la temperatura inicial y la final ∆T = Tf -Ti . Su unidad de medida en el Sistema Internacional es el kelvín ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC )
Signo del calor
- Si la temperatura aumenta, Tf > Ti ⇒ ∆T > 0 ⇒ Q > 0 ⇒ el calor es positivo, el cuerpo gana energía térmica
- Si la temperatura disminuye, Tf < Ti ⇒ ∆T < 0 ⇒ Q < 0 ⇒ el calor es negativo, el cuerpo pierde energía térmica
Unidades de medida del calor
Las unidades de medida más usadas para el calor son:- El julio ( J ). Es la unidad del calor en el Sistema Internacional. Las unidades del calor son iguales a las unidades del trabajo ya que ambos son procesos de intercambio de energía
- La caloría ( cal ). Representa la cantidad de energía que hay que suministrar a un gramo de agua para que aumente su temperatura 1 ºC
- 1 cal = 4.184 J
- La kilocarloría ( kcal ). También conocida como caloría
grande, en contraposición a la caloría, que se conoce como caloría
pequeña. Normalmente se usa en nutrición
- 1 kcal = 1000 cal
- La unidad térmica británica ( BTU ). Representa la cantidad de calor que hay que suministrar a una libra de agua para que aumente su temperatura 1 ºF
- 1 BTU = 252 cal
- Qué es el calor
- Cómo se relaciona el calor con el cambio de temperatura a través de:
- Cómo se relaciona el calor con los cambios en el estado de agregación
- Qué ocurre cuando dos cuerpos a distinta temperatura se ponen en contacto
- Los mecanismos de propagación del calor
Concepto de calor
Las partículas de los cuerpos no están en reposo sino que se encuentran en constante agitación. Como consecuencia de esta agitación, los cuerpos poseen una determinada energía térmica. La temperatura es un indicador de la energía térmica que tienen los cuerpos. De modo general podemos decir que, a mayor temperatura, mayor energía térmica. Pues bien, los cuerpos y los sistemas pueden intercambiar energía térmica. A esta energía térmica intercambiada se le denomina calor. En ocasiones también se denomina calor al propio proceso de transferencia de energía.
El calor es la energía intercambiada entre un cuerpo y su entorno por el hecho de encontrarse a distinta temperatura. El calor, como el trabajo, es energía en tránsito, por lo que se puede entender también como un método para transferir energía.
¿Es lo mismo calor que temperatura?
No, calor y temperatura no son la misma cosa. Es muy posible que esta idea te parezca extraña porque cotidianamente la solemos confundir. Sin embargo te proponemos el siguiente experimento.- Llena dos ollas de agua, una con la mitad o la tercera parte de agua que la otra
- Ponlas ambas sobre una llama de igual intensidad. Anota el tiempo que tarda cada una de ellas en empezar a hervir
- Mide la temperatura de cada una en el momento en que empiezan a hervir
- La que tiene menos agua empieza a hervir antes, o lo que es lo mismo, ha necesitado menos energía para llegar al punto de ebullición.
- Si mides la temperatura al comenzar a hervir en los dos casos, ambas temperaturas son iguales (en torno a 100 ºC).

Capacidad calorífica
Cuando colocas aceite en una sartén y enciendes el fuego, el aceite comenzará a aumentar su temperatura. En general, cuando suministramos calor a un cuerpo este puede aumentar su temperatura.
La capacidad calorífica de
un cuerpo es la relación que hay entre el calor suministrado al cuerpo y
su incremento de temperatura. Se puede calcular a través de la
expresión:
Donde:
Donde:
- C : Capacidad calorífica. Es la cantidad de calor que el cuerpo tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kelvín ( J/K ), aunque también se usa con frecuencia la caloría por grado centígrado ( cal/ºC )
- Q : Calor intercambiado. Cantidad de energía térmica intercambiada con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se usa con frecuencia la caloría ( cal ). 1 cal = 4.184 J
- ∆T : Variación de temperatura. Viene determinada por la diferencia entre la temperatura inicial y la final ∆T = Tf -Ti . Su unidad de medida en el Sistema Internacional es el kelvín ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC )
¿De qué depende la capacidad calorífica?
La capacidad calorífica de un cuerpo depende de dos factores:- La sustancia por la que está formado el cuerpo: No aumentan su temperatura de igual manera un gramo de agua que un gramo de aceite o un gramo de hierro, aún cuando se sitúen sobre un fuego de igual intensidad: El hierro sería el primero en aumentar su temperatura, seguido del aceite y finalmente el agua
- La cantidad de masa del cuerpo: Tal y como has podido comprobar en el experimento anterior, no aumenta su temperatura de igual manera un gramo y un kilogramo de agua, aún cuando se sitúen sobre un fuego de igual intensidad: un gramo de agua variará su temperatura más rapidamente que un kilogramo de esta misma sustancia
Calor específico
El calor específico se obtiene a partir de la capacidad calorífica y representa la dificultad con que una sustancia intercambia calor con el entorno. Es una característica de las sustancias que forman los cuerpos y es independiente de la masa.
El calor específico de una sustancia es su capacidad calorífica por unidad de masa. Viene dada por la expresión:
Donde:
Donde:
- c : Calor específico. Es la cantidad de calor que la unidad de masa de la sustancia tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC )
- C : Capacidad calorífica. Es la cantidad de calor que el cuerpo tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kelvín ( J/K ), aunque también se usa con frecuencia la caloría por grado centígrado ( cal/ºC )
- m: Masa. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
Calor específico molar
En ocasiones, particularmente en el caso de sustancias gaseosas, conviene usar el mol como unidad de masa. De esta manera, el calor específico queda referido a la unidad de masa según la expresión:Características del calor específico
Algunas características del calor específico son:- Cuanto mayor es el calor específico de una sustancia, más calor hay que intercambiar para conseguir variar su temperatura
- Existe un rango de temperaturas dentro del cual el calor específico es constante. Aunque a la hora de resolver los ejercicios de este nivel se considera c constante, en realidad el calor específico de cualquier sustancia varía con la temperatura
- Según si el proceso de intercambio de energía (calor) tiene lugar a presión constante o a volumen constante se habla de calor específico a presión constante cp o calor específico a volumen constante cv. Si no se especifica, el proceso se supone a presión constante de 1 atm
- Normalmente en sólidos y líquidos cp ≈ cv
- Normalmente en gases cp ≠ cv
Ecuación fundamental de la termología
Gracias al concepto de calor específico disponemos de una expresión para determinar el calor agregado o extraido de una sustancia a partir del incremento en su temperatura, su calor específico y la cantidad de masa que tenemos. A esta expresión se la conoce como la ecuación fundamental de la termología.
La ecuación fundamental de la termología
establece la relación entre el incremento de temperatura experimentado
por una determinada cantidad de sustancia y el calor que intercambia:
Donde:
Donde:
- Q : Calor intercambiado. Cantidad de energía térmica intercambiada con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se usa con frecuencia la caloría ( cal ). 1 cal = 4.184 J
- m : Masa. Cantidad de sustancia considerada. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- c : Calor específico. Representa la facilidad que una sustancia tiene para variar su temperatura cuando intercambia calor con el entorno. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC ). Cuando conocemos el número de moles de sustancia en lugar de su peso (nos dan m en moles), podemos usar el calor específico molar que se suele específicar en J/mol·K ó cal/g·ºC
- ∆T : Variación de temperatura. Viene determinada por la diferencia entre la temperatura inicial y la final ∆T = Tf -Ti . Su unidad de medida en el Sistema Internacional es el kelvín ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC )
Signo del calor
- Si la temperatura aumenta, Tf > Ti ⇒ ∆T > 0 ⇒ Q > 0 ⇒ el calor es positivo, el cuerpo gana energía térmica
- Si la temperatura disminuye, Tf < Ti ⇒ ∆T < 0 ⇒ Q < 0 ⇒ el calor es negativo, el cuerpo pierde energía térmica
Unidades de medida del calor
Las unidades de medida más usadas para el calor son:- El julio ( J ). Es la unidad del calor en el Sistema Internacional. Las unidades del calor son iguales a las unidades del trabajo ya que ambos son procesos de intercambio de energía
- La caloría ( cal ). Representa la cantidad de energía que hay que suministrar a un gramo de agua para que aumente su temperatura 1 ºC
- 1 cal = 4.184 J
- La kilocarloría ( kcal ). También conocida como caloría
grande, en contraposición a la caloría, que se conoce como caloría
pequeña. Normalmente se usa en nutrición
- 1 kcal = 1000 cal
- La unidad térmica británica ( BTU ). Representa la cantidad de calor que hay que suministrar a una libra de agua para que aumente su temperatura 1 º .1 BTU = 252 cal
Calor y cambios de estado de agregación de la materia
Otro efecto del calor sobre los cuerpos, junto con el cambio de temperatura, es el cambio en el estado de agregación de la materia. Recuerda que la materia se encuentra fundamentalmente en uno de estos tres estados de agregación posibles:- sólido
- líquido
- gaseoso
- El cuerpo intercambia calor con su entorno: Si el cuerpo no puede absorber o ceder calor, permanecerá en el mismo estado
- El cambio de estado es un proceso térmicamente reversible, es decir, la cantidad de calor absorbida en la transformación directa ( proceso endotérmico ) es exactamente igual a la cantidad cedida en la transformación inversa ( proceso exotérmico ): Por ejemplo para pasar de hielo a agua líquida se necesita suministrar el mismo calor que se desprende cuando se pasa de agua líquida a hielo.

- La temperatura permanece constante: El calor absorbido o cedido se emplea en el cambio de estado y no en variar la temperatura.

La cantidad de calor absorbida o cedida durante un proceso de cambio de estado viene dada por la expresión:
Donde:
Donde:
- Q : Calor intercambiado. Cantidad de energía térmica intercambiada con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se usa con frecuencia la caloría ( cal ). 1 cal = 4.184 J
- m: Masa. Cantidad de sustancia considerada. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- L : Variación de entalpía o calor latente. Es la cantidad de calor por unidad de masa necesaria para realizar el cambio de estado. Su unidad de medida en el Sistema Internacional es el julio por kilogramo ( J/kg ) aunque también se suele usar la caloría por gramo ( cal/g )
Equilibrio térmico
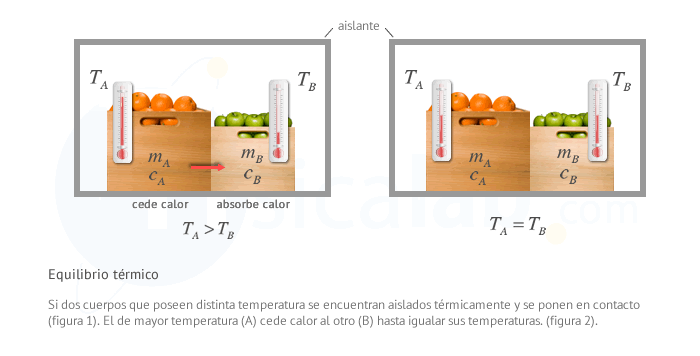
Cuando dos cuerpos a distinta temperatura se ponen en contacto se inicia un proceso de intercambio de calor que iguala sus temperaturas. Imagina que sumerges una barra de hierro al rojo vivo en un recipiente con agua a temperatura ambiente. Cuando pasa el tiempo, la temperatura final del agua habrá subido, y la de la barra de hierro habrá bajado, pero ambas son iguales: han llegado al equilibrio térmico.
Se dice que dos cuerpo están en equilibrio térmico
cuando están a la misma temperatura, y por tanto no intercambian calor.
La ecuación de equilibrio térmico indica que el calor que absorbe un
cuerpo es igual que el calor que cede el otro, es decir:
Donde:
Donde:
- mA ,mB : Masas de los cuerpos A y B respectivamente. Es la cantidad de sustancia considerada de cada cuerpo. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- cA , cB : Calor específico del cuerpo A y del cuerpo B respectivamente. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC )
- Temperaturas TA, TB y T : Temperatura inicial del cuerpo A, del cuerpo B y temperatura final de equilibrio térmico respectivamente. Su unidad de medida en el Sistema Internacional es el Kelvin ( K )

Comprobación
Un aislante térmico es un material que, idealmente, no intercambia calor con el entorno. Si ponemos en contacto en el interior de un aislante térmico dos cuerpos A y B a distintas temperaturas TA y TB con TA > TB , se comprueba empíricamente que las tempteraturas de ambos cuerpos tienden a igualarse si dejamos que pase el suficiente tiempo a una temperatura T. Esto sucede por que la temperatura es una variable de estado y las variables de estado tienen igual valor en todos los puntos del sistema (en este caso, el sistema formado por los dos cuerpos, completamente aislados del exterior). La variación de temperatura se produce debido a un intercambio de calor entre ambos cuerpos de manera que el calor que absorbe el primero debe ser igual al calor que cede el segundo, quedando:Propagación del calor
Existen 3 mecanismos por los cuales los cuerpos intercambian su energía térmica: Conducción, convección y radiacion. Vamos a estudiarlos.Conducción
En la conducción dos cuerpos que se encuentran directamente en contacto (o partes de un mismo cuerpo a distinta temperatura) intercambian energía sin que exista transporte de materia. Se basa en la transferencia directa de energía cinética a escala molecular. Cada sustancia tiene un valor asociado de conductividad térmica que indica la rapidez con que es capaz de transferir la energía. Su unidad de medida en el Sistema Internacional es el watio por metro y por grado kelvin ( W·m-1·K-1 ). Las sustancias pueden ser:- Buenos conductores térmicos: Poseen una alta conductividad
- Malos conductores térmicos: Poseen una baja conductividad

Convección
Se produce en líquidos y gases. En este caso si existe transporte de materia. El calor se propaga debido a unas corrientes denominadas corrientes de convección que se producen entre las distintas partes de la sustancia. Aquellas a mayor temperatura (por estar en contacto con la fuente de calor) disminuyen su densidad respecto a las más frías. Las partes menos densas (más calientes) se desplazan a las capas altas y las más densas (más frías) a las bajas. Al cabo del tiempo, se repite el proceso al enfriarse las capas superiores y calentarse las inferiores, dando lugar así a una corriente de convección. Este fenómeno se da, por ejemplo, cuando calentamos un agua en una olla.
Radiación
Se produce por la propagación de energía electromagnética a través del espacio. No es necesaria la presencia de materia. Por ejemplo, cuando el Sol calienta la Tierra, su energía recorre una gran distancia en el espacio vacío. El sol es un claro ejemplo de cuerpo que emite radiación electromagnética debido a su temperatura. Sin embargo todos los cuerpos, por el hecho de encontrarse a cierta temperatura, emiten radiación térmica. Dicha radiación es de naturaleza electromagnética y, en el caso de los cuerpos muy calientes, como el sol, está dentro del rango de luz visible. Para otros objetos la radiación es invisible a nuestros ojos.
La termodinámica es la parte de la física que se encarga de la relación entre el calor y el trabajo. En este apartado estudiaremos:
- La equivalencia entre unidades de trabajo y de calor
- Qué estudia la termodinámica
- Los componentes principales de un sistema termodinámico
- Qué son las variables de estado y como se relacionan entre sí
- Los principios que rigen la termodinámica
- Los criterios de signos más extendidos en termodinámica
Relación entre trabajo y calor
Tanto el calor como el trabajo son modos en que los cuerpos y los sistemas transforman su energía. Esto permite establecer un equivalente mecánico del calor. Observa los siguientes ejemplos:- De trabajo mecánico a calor: Frota dos bloques de hielo, y comprobarás que se derriten, aún cuando estés en una camara frigorífica a una temperatura menor de 0 ºC
- De calor a trabajo mecánico: En una máquina de vapor,la expansión del vapor de agua que se calienta produce el desplazamiento del pistón
Trabajo y calor son métodos de transferencia de energía. Utilizan la misma unidad de medida en el Sistema Internacional, el julio ( J ). Además, es habitual utilizar la caloría ( cal ) para medir el calor. La conversión entre calorías y julios viene dada por:
1 cal = 4.184 J ⇔ 1 J = 0.24 cal
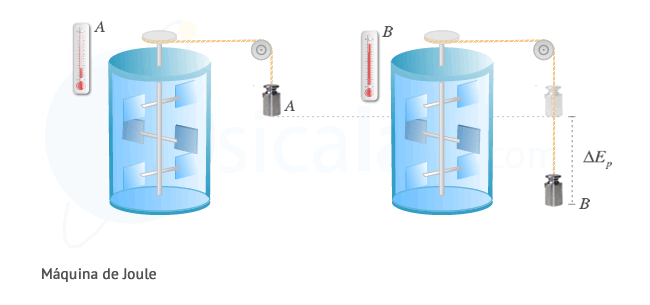
Experimento de Joule
Joule ideó una mágina conformada por una pesa unida a unas aspas por medio de un sistema de poleas, que se encuentran sumergidas en un recipiente de vidrio lleno de agua. Cuando se deja caer la pesa desde la posición A hasta B, tal y como se muestra en la figura, esta pierde su energía potencial invirtiéndose en girar las aspas dentro del líquido. La fricción de las aspas con el agua provoca un aumento de la temperatura del mismo. A partir de los resultados obtenidos con esta máquina se obtuvo la equivalencia establecida anteriormente:
1 cal = 4.184 J ⇔ 1 J = 0.24 cal

¿Qué estudia la termodinámica?
La termodinámica proviene de dos disciplinas separadas hasta el S.XIX, la termología y la mecánica. La primera se encargaba de los fenómenos exclusivamente térmicos y la segunda trataba el movimiento, la fuerza y el trabajo.
La termodinámica es la parte de la física que estudia las transferencias de calor, la conversión de la energía y la capacidad de los sistemas para producir trabajo. Las
leyes de la termodinámica explican los comportamientos globales de los
sistemas macroscópicos en situaciones de equilibrio.
- Se aplica al estudio de sistemas que contienen muchas partículas y no al estudio de moléculas, átomos o partículas subatómicas
- Estudia el sistema en situaciones de equilibrio, que son aquellas a las que sistema tiende a evolucionar y caracterizadas porque en ellas todas las propiedades del sistema quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas
- Sus postulados son indemostrables, están basados en las experiencias y no en razonamientos teóricos
Componentes de un sistema termodinámico

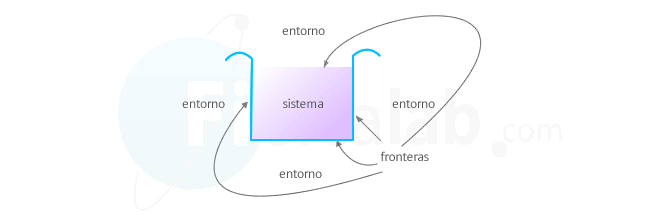
Sistema
El sistema es la parte del universo que vamos a estudiar. Por ejemplo, un gas, nuestro cuerpo o la atmósfera son ejemplos de sistemas que podemos estudiar desde el punto de vista termodinámica.Entorno o ambiente
Todo aquello que no es sistema y que se sitúa alrededor de él, se denomina ambiente o entorno. Los sistemas interaccionan con el entorno transfiriendo masa, energía o las dos cosas. En función de ello los sistemas se clasifican en:| Tipo | Intercambia | Ejemplo |
|---|---|---|
| Abierto | Masa y energía (trabajo o calor) | Reacción química en tubo de ensayo abierto |
| Cerrado | Sólo energía | Radiador de calefacción |
| Aislado | Ni materia ni energía | Termo para mantener bebidas a temperatura constante |
| Adiabático | Ni materia ni calor, pero si energía en forma de trabajo | Termo con tapa que permita variar volumen |
Frontera o paredes del sistema
A través de ellas se comunica el sistema con el entorno. Existen los siguientes tipos:- Fijas: Mantienen el volumen constante
- Móviles: El volumen es variable y depende de la presión en el lado del sistema y de la del entorno
- Conductoras o diatérmanas: Al conducir calor permiten que la temperatura a ambos lados de la misma sea igual
- Adiabáticas: No conducen calor. Son los aislantes térmicos
Variables y ecuación de estado
Las variables de estado son el conjunto de valores que adoptan ciertas variables físicas y químicas y que nos permiten caracterizar el sistema. A las variables de estado también se las llama funciones de estado. No todos los sistemas termodinámicos tienen el mismo conjunto de variables de estado. En el caso de los gases son:- presión
- volumen
- masa
- temperatura
La ecuación de estado de los gases ideales sigue la expresión:
Donde:
Donde:
- p : Presión. Su unidad de medida en el Sistema Internacional es el pascal ( Pa ) aunque también se suele usar la atmósfera ( atm ). 1 atm = 101325 Pa
- V : Volumen. Su unidad de medida en el Sistema Internacional es metro cúbico ( m3 ) aunque también se suele usar el litro ( l o L ). 1 L = 1 dm3 = 10-3m3
- n : Número de moles. Se trata de una unidad de masa. Un mol de una sustancia se compone del número de Avogadro, NA = 6.023·1023 de moléculas de esa sustancia, y su peso coincide con la masa molecular de la sustancia expresada en gramos. La unidad de medida en el Sistema Internacional para el número de moles es el mol ( mol )
- R : Constante universal de los gases. Su valor en unidades del Sistema Internacional es R = 8.31 J / mol·K, aunque también se usa R = 0.083 atm·l / mol·K
- T : Temperatura. Su unidad de medida en el Sistema Internacional es el kelvin ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC ). T = tC + 273.15
Finalmente, decimos que un sistema ha alcanzado el estado de equilibrio cuando sus variables de estado permanecen constantes. Todas las propiedades del sistema en equilibrio quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas. La termodinámica sólo se ocupa de sistemas en estado de equilibrio.
Variables intensivas y extensivas
- Intensivas: Son aquellas que no dependen del tamaño del sistema. Por ejemplo la presión, la temperatura, la concentración o la densidad
- Extensivas: Son aquellas que dependen del tamaño del sistema. Por ejemplo el volumen, la masa o la energía
Las leyes de la termodinámica
Las leyes de la termodinámica son principios empíricos que no se pueden demostrar por estar basados en la experiencia y no en razonamientos teóricos. Están referidos a sistemas en estado de equilibrio. Son cuatro, aunque los más importantes son el primero y el segundo:- Principio cero de la termodinámica
- Primer principio de la termodinámica
- Segundo principio de la termodinámica
- Tercer principio de la termodinámica
Criterio de signos en termodinámica
Existen dos criterios de signos ampliamente extendidos en termodinámica para relacionar el trabajo y el calor que intercambia un sistema con el entorno:-
Criterio de la IUPAC: Se considera positivo todo lo que aumenta la energía del sistema, es decir, calor recibido y trabajo recibido
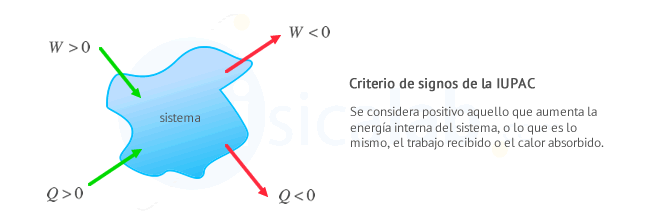
-
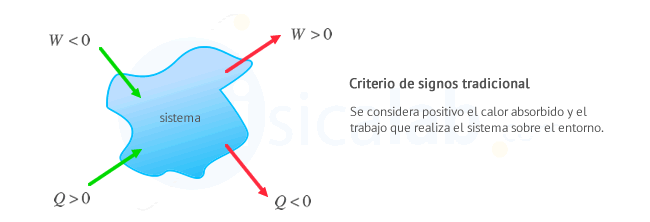
Criterio Tradicional: Se considera positivo el calor recibido por el
sistema y el trabajo que realiza el sistema sobre el entorno. Este
criterio es util en el estudio de máquinas térmicas en el que interesa
que el trabajo realizado por las máquinas (el sistema) sea positivo
Las leyes de la termodinámica
Las leyes de la termodinámica son principios empíricos que no se pueden demostrar por estar basados en la experiencia y no en razonamientos teóricos. Están referidos a sistemas en estado de equilibrio. Son cuatro, aunque los más importantes son el primero y el segundo:- Principio cero de la termodinámica
- Primer principio de la termodinámica
- Segundo principio de la termodinámica
- Tercer principio de la termodinámica
Criterio de signos en termodinámica
Existen dos criterios de signos ampliamente extendidos en termodinámica para relacionar el trabajo y el calor que intercambia un sistema con el entorno:-
Criterio de la IUPAC: Se considera positivo todo lo que aumenta la energía del sistema, es decir, calor recibido y trabajo recibido

-
Criterio Tradicional: Se considera positivo el calor recibido por el
sistema y el trabajo que realiza el sistema sobre el entorno. Este
criterio es util en el estudio de máquinas térmicas en el que interesa
que el trabajo realizado por las máquinas (el sistema) sea positivo

La ley cero de la termodinámica permite establecer el concepto de temperatura. En este apartado vamos a estudiarla.
 Observa que podemos decir que dos cuerpos tienen la misma temperatura cuando están en equilibrio térmico entre sí.
Observa que podemos decir que dos cuerpos tienen la misma temperatura cuando están en equilibrio térmico entre sí.
Aunque la ley cero puede parecer evidente, lo cierto es que no es
necesariamente lógica. Imagina un triángulo amoroso en el que Juan ama a
Lidia y Pedro ama a Lidia, sin embargo Juan y Pedro no se aman entre
sí.
Finalmente, quizás te estés preguntando por qué el inusual término ley cero. La razón es que, aunque precede a la primera ley, la necesidad de establecerla como principio de la termodinámica sólo se admitió después de que la primera hubiese tomado su nombre.
La primera ley de la termodinámica relaciona el trabajo y el calor transferido intercambiado en un sistema a través de una nueva variable termodinámica, la energía interna. Dicha energía ni se crea ni se destruye, sólo se transforma. En este apartado estudiaremos:
En definitiva, en el interior de un sistema conviven distintos tipos de energía, asociadas a las partículas microscópicas que los componen y que forman su energía interna.
Observa que el valor de U es la suma de todas las energías del interior del sistema, por lo que no se incluye ni la energía cinética global ni la energía potencial gravitatoria global ni la energía potencial elástica global del mismo.
La expresión anterior nos da un método operativo para medir la
variación de energía interna en un sistema gaseoso, proporcional al
cambio de temperatura. Para llegar a ella aplicamos la primera ley de la
termodinámica a un proceso a volumen constante (denominado isocórico)
como podrás comprobar más abajo.
Al igual que todos los principios de la termodinámica, el primer principio se basa en sistemas en equilibrio.
Por otro lado, es probable que hayas oído más de una vez que la energía ni se crea ni se destruye, solo se transforma. Se trata del principio general de conservación de la energía. Pues bien, la primera ley de la termodinámica es la aplicación a procesos térmicos de este principio. En un sistema aislado, en el que no se intercambia energía con el exterior, nos queda:
∆U=0
El universo en su totalidad se podría considerar un sistema aislado, y por tanto, su energía total permanece constante.
Finalmente observa que, al ser una función de estado, la diferencia de energía interna solo depende de los estados inicial y final, ∆U = Uf - Ui , y no del camino que haya seguido el proceso. El calor y el trabajo, en cambio, no son funciones de estado, por lo que sus valores dependen del caminio seguido por el proceso. Esto quedará bien ilustrado en los diagramas presión - volumen para gases ideales, como verás más abajo.
Normalmente el trabajo termodinámico está asociado al movimiento de
alguna parte del entorno, y resulta indiferente para su estudio si el
sistema en sí está en movimiento o en reposo. Por ejemplo, cuando
calientas un gas ideal en un recipiente con un pistón móvil en su parte
superior, las partículas adquieren mayor energía cinética. Este aumento
en la energía de las partículas se traduce en un aumento de la energía
interna del sistema que, a su vez, puede traducirse en un desplazamiento
del pistón. El estudio de este proceso desde el punto de vista de la
termodinámica es independiente de si el sistema,como un todo, se
encuentra en reposo o en movimiento, que sería una cuestión de mecánica.
Sin embargo sí es cierto que, tal y como ocurre en una máquina de
vapor, la energía de dicho trabajo termodinámico puede transformarse en energía mecánica.
Presta atención al signo del trabajo, realizado por el sistema, en función del criterio de signos.
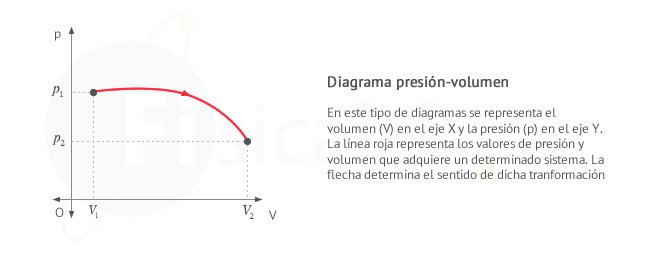 Las gráficas presión volumen nos sirven para calcular el trabajo
realizado en un proceso en el que la presión no necesariamente tenga que
ser constante.
Las gráficas presión volumen nos sirven para calcular el trabajo
realizado en un proceso en el que la presión no necesariamente tenga que
ser constante.
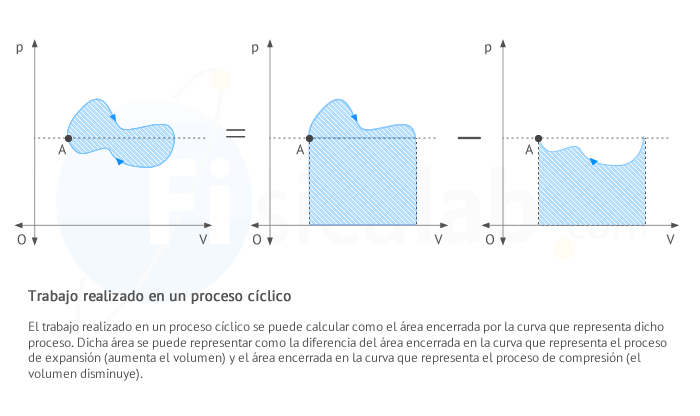
Observa que en un proceso cíclico el área encerrada
por la curva se puede calcular como la resta entre el valor del área
encerrada por la curva cuando el proceso se encuentra aumentando su
volumen (en expansión) y el valor del área encerrada por la curva cuando
el proceso se encuentra disminuyendo su volumen (en compresión), tal y
como puede verse en la siguiente figura.
p⋅V=n⋅R⋅T la más sencilla.
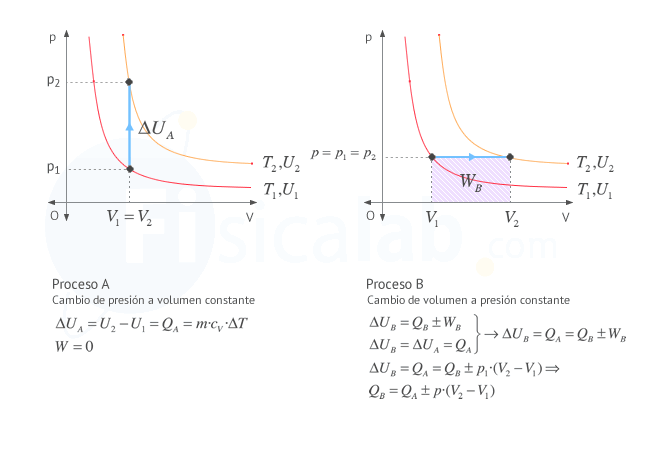 Como puedes observar en la figura si conocemos el incremento de
energía interna en un proceso a volumen constante (proceso A), que
experimentalmente es sencillo de determinar, se puede aplicar la primera
ley de la termodinámica para conocer el trabajo el calor de otro
proceso (proceso B) que termine en el mismo estado, o lo que es lo
mismo, en la misma línea isoterma.
Como puedes observar en la figura si conocemos el incremento de
energía interna en un proceso a volumen constante (proceso A), que
experimentalmente es sencillo de determinar, se puede aplicar la primera
ley de la termodinámica para conocer el trabajo el calor de otro
proceso (proceso B) que termine en el mismo estado, o lo que es lo
mismo, en la misma línea isoterma.
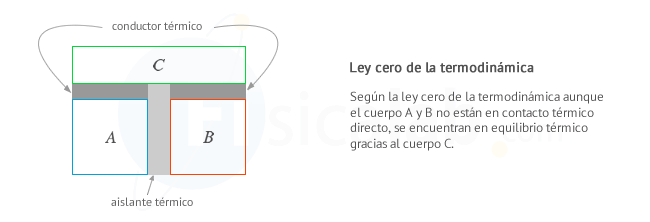
Ley cero de la termodinámica
Se dice que dos cuerpos están en equilibrio térmico cuando, al ponerse en contacto, sus variables de estado no cambian. En torno a esta simple idea se establece la ley cero.
La ley cero de la termodinámica establece
que, cuando dos cuerpos están en equilibrio térmico con un tercero,
estos están a su vez en equilibrio térmico entre sí.

Finalmente, quizás te estés preguntando por qué el inusual término ley cero. La razón es que, aunque precede a la primera ley, la necesidad de establecerla como principio de la termodinámica sólo se admitió después de que la primera hubiese tomado su nombre.
La primera ley de la termodinámica relaciona el trabajo y el calor transferido intercambiado en un sistema a través de una nueva variable termodinámica, la energía interna. Dicha energía ni se crea ni se destruye, sólo se transforma. En este apartado estudiaremos:
- Qué es la energía interna de un cuerpo
- El primer principio de la termodinámica
- El concepto de trabajo termodinámico
- Cómo extraer información útil de las gráficas presión - volumen
- Cuáles son los principales tipos de procesos termodinámicos
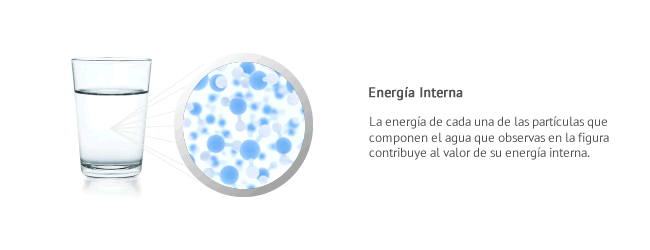
Energía interna
La energía interna de un sistema es una caracterización macroscópica de la energía microscópica de todas las partículas que lo componen. Un sistema está formado por gran cantidad de partículas en movimiento. Cada una de ellas posee:- energía cinética, por el hecho de encontrarse a una determinada velocidad
- energía potencial gravitatoria, por el hecho de encontrarse en determinadas posiciones unas respecto de otras
- energía potencial elástica, por el hecho vibrar en el interior del sistema
En definitiva, en el interior de un sistema conviven distintos tipos de energía, asociadas a las partículas microscópicas que los componen y que forman su energía interna.
En termodinámica la energía interna de un sistema ( U ) es una variable de estado.
Representa la suma de todas las energías de las partículas
microscópicas que componen el sistema. Su unidad de medida en el Sistema
Internacional es el julio ( J ).
Energía interna en gases ideales
En los gases ideales, la energía interna se puede aproximar a la energía cinética media de las partículas que lo componen. La expresión que se recoge más abajo permite determinar su variación en un proceso cuyo volumen permanece constante (proceso isocórico).
La energía interna de un gas ideal depende únicamente de la temperatura que tenga el gas. La variación de energía interna que experimenta un gas al cambiar de temperatura viene dada por:
Donde:
Donde:
- ∆U : Incremento de energía interna del gas ( ∆U = Ufinal - Uinicial ). Su unidad de medida en el Sistema Internacional es el julio ( J )
- m : Masa. Cantidad de gas considerada. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- cv : Calor específico a volumen constante. Representa la facilidad que el gas tiene para variar su temperatura cuando intercambia calor con el entorno. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC ). Cuando conocemos el número de moles de sustancia en lugar de su peso (nos dan m en moles), podemos usar el calor específico molar que se suele específicar en J/mol·K ó cal/g·ºC
- ∆T : Variación de temperatura. Viene determinada por la diferencia entre la temperatura inicial y la final ∆T = Tf -Ti . Su unidad de medida en el Sistema Internacional es el kelvín ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC )

Primera ley de la termodinámica
La primera ley de la termodinámica establece una relación entre la energía interna del sistema y la energía que intercambia con el entorno en forma de calor o trabajo.
La primera ley de la termodinámica determina que la energía interna de un sistema aumenta cuando se le transfiere calor o se realiza un trabajo sobre él. Su expresión depende del criterio de signos para sistemas termodinámicos elegido:
Donde:
Criterio IUPAC
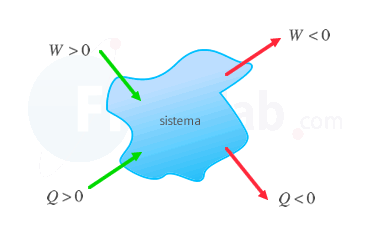 |
Criterio tradicional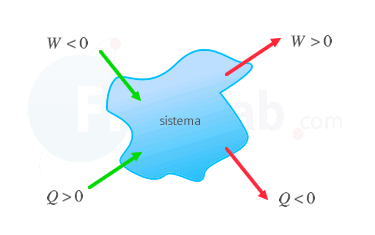 |
- ∆U : Incremento de energía interna del sistema ( ∆U = Ufinal - Uinicial ). Su unidad de medida en el Sistema Internacional es el julio ( J )
- Q : Calor intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se suele usar la caloría ( cal ). 1 cal = 4.184 J
- W : Trabajo intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J )
Por otro lado, es probable que hayas oído más de una vez que la energía ni se crea ni se destruye, solo se transforma. Se trata del principio general de conservación de la energía. Pues bien, la primera ley de la termodinámica es la aplicación a procesos térmicos de este principio. En un sistema aislado, en el que no se intercambia energía con el exterior, nos queda:
Finalmente observa que, al ser una función de estado, la diferencia de energía interna solo depende de los estados inicial y final, ∆U = Uf - Ui , y no del camino que haya seguido el proceso. El calor y el trabajo, en cambio, no son funciones de estado, por lo que sus valores dependen del caminio seguido por el proceso. Esto quedará bien ilustrado en los diagramas presión - volumen para gases ideales, como verás más abajo.
Trabajo termodinámico
La energía interna de un cuerpo no incluye la energía cinética global o potencial mecánica del mismo, tal y como señalamos anteriormente. Es por ello que no se ve alterada con el trabajo mecánico. En termodinámica nos interesa otro tipo de trabajo, capaz de variar la energía interna de los sistemas. Se trata del trabajo termodinámico.
Se denomina trabajo termodinámico
a la transferencia de energía entre el sistema y el entorno por métodos
que no dependen de la diferencia de temperaturas entre ambos. Es capaz
de variar la energía interna del sistema.
Trabajo termodinámico presión - volumen
El trabajo termodinámico más habitual tiene lugar cuando un sistema se comprime o se expande y se denomina trabajo presión - volumen (p - v). En este nivel educativo estudiaremos su expresión en procesos isobáricos o isobaros, que son aquellos que se desarrollan a presión constante.
El trabajo presión - volumen realizado por un sistema que se comprime o se expande a presión constante viene dado por la expresión:
Donde:
Criterio IUPAC
 |
Criterio tradicional
 |
- Wsistema : Trabajo intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J )
- p : Presión. Su unidad de medida en el Sistema Internacional es el pascal ( Pa ) aunque también se suele usar la atmósfera ( atm ). 1 atm = 101325 Pa
- ∆V : Variación de volumen ( ∆V=Vf - Vi ). Su unidad de medida en el Sistema Internacional es metro cúbico ( m3 ) aunque también se suele usar el litro ( l o L ). 1 L = 1 dm3 = 10-3 m3
- Criterio IUPAC
- Compresión Vi > Vf ⇒ Wsistema > 0 ⇒ El trabajo lo recibe el sistema del entorno ⇒ Aumenta la energía interna del sistema ⇒ ∆U > 0
- Expansión: Vi < Vf ⇒ Wsistema < 0 ⇒ El trabajo lo cede el sistema al entorno ⇒ Disminuye la energía interna del sistema ⇒ ∆U < 0
- Criterio tradicional
- Compresión Vi > Vf ⇒ Wsistema < 0 ⇒ El trabajo lo recibe el sistema del entorno ⇒ Aumenta la energía interna del sistema ⇒ ∆U > 0
- Expansión: Vi < Vf ⇒ Wsistema > 0 ⇒ El trabajo lo cede el sistema al entorno ⇒ Disminuye la energía interna del sistema ⇒ ∆U < 0
Gráficas presión - volumen
En el estudio del trabajo realizado por un sistema termodinámico con gases ideales es bastante común el uso de diagramas presión - volumen ( p - v ).- Se representa el volumen V en el eje x
- Se representa la presión p en el eje y
- Se representa el proceso mediante una linea que une los puntos ( V ,p ) por los que este pasa entre el punto inicial ( Vi ,pi ) y el final ( Vf ,pf )
- Utilizaremos una flecha sobre la linea para indicar el sentido de la transformación termodinámica

El trabajo realizado por un sistema termodinámico
coincide numéricamente con el area encerrada bajo la gráfica presión -
volumen entre los valores de volumen inicial Vi y final Vf. El sentido
de la flecha sobre la linea indica el signo del trabajo, según el
criterio elegido
Criterio IUPAC
 |
Criterio tradicional
 |
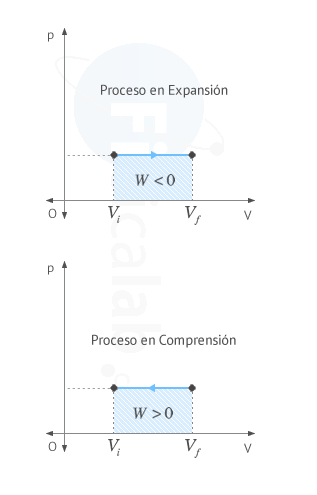 |
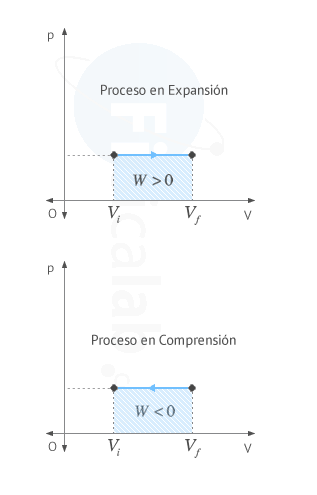 |

Interpretación de gráficas de gases ideales
Los diagramas presión volumen aportan gran cantidad de información, además de servir para el cálculo del trabajo realizado por el sistema. Vamos a particularizar en el caso de los gases ideales por ser su ecuación de estado-
Cada punto de la gráfica marca un estado del sistema.
Las variables de estado para una determinada cantidad de gas, son la
presión, el volumen y la temperatura. Un punto en la gráfica p - v tiene
una única temperatura asociada, según la expresión
p⋅V=n⋅R⋅T⇒T=p⋅Vn⋅R , y por tanto cada punto marca un estado
-
Se puede demostrar que la energía interna U
de un gas ideal depende únicamente de su temperatura. Así, a cada punto
en la gráfica se le asocia, además de una temperatura, una energía
interna.
-
Se denominan isotermas a las lineas que representan igual temperatura. Siguen la expresión
pi⋅Vi=n⋅R⋅Ti=cte y corresponden con el conjunto de puntos que tienen, además, igual energía interna
-
Trabajo y calor dependen, en general, del camino seguido para llegar a un punto a otro de la gráfica, de la transformación.
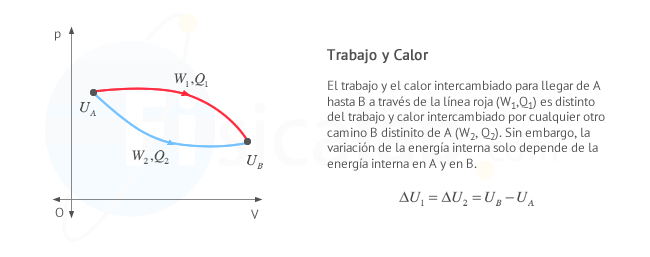
-
En un proceso cíclico, la temperatura inicial y final es la misma, por tanto la energía interna del sistema no varía
∆U=Uf−Ui=0 , independientemente del camino seguido. Sin embargo recuerda que calor y trabajo intercambiados en el proceso no son funciones de estado y sí dependen, en general, del camino

-
Para determinar el incremento de energía interna
∆U en cualquier tipo de proceso, se utiliza la expresión∆U=m⋅cv⋅∆T . ¿De donde viene? En un proceso a volumen constante (denominado proceso isocórico) no se realiza trabajo, pues el área bajo la curva del proceso es 0 y, en consecuencia, la primera ley de la termodinámica queda:
El calor recibido por un gas a volumen constante viene dado por la expresión∆U=Q Q=m⋅cv⋅∆T . Combinando las dos expresiones anteriores, nos queda justamente la expresión buscada∆U=m⋅cv⋅∆T .
Observa que, al depender el incremento de energía interna únicamente de los estados inicial y final (de la temperatura inicial y final), el valor obtenido será el mismo siempre que nos desplacemos a la misma isoterma, independientemente del camino seguido. Esto significa que, aunque el valor del incremento de energía se haya obtenido para un proceso a volumen constante, también será válido para cualquier proceso que se desplace a la misma isoterma. Puedes comprobarlo en este ejercicio.
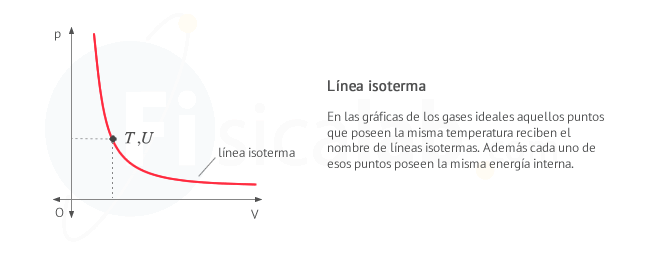

Tipos de procesos
Los procesos termodinámicos se suelen clasificar en:-
Q = 0 Procesos adiabáticos. Aquellos en los que el
sistema no intercambia calor. Por ejemplo, al usar un ambientador o
desodorante en aerosol se produce un proceso casi adiabático. En estos
casos
∆U=W (ó∆U=−W , según criterio de signos elegido), es decir, el trabajo es función de estado. Cuando comprimimos o expandimos un gas en un proceso en el que no se intercambia calor, variamos su energía interna y, por tanto, su temperatura
-
V = cte. Procesos isocóricos. Aquellos en los que
el volumen permanece constante. Por ejemplo, una botella de champán
metida en un recipiente con hielo. Al no haber variación de volumen, el
trabajo del sistema es cero.
Wsistema=0 . Siguiendo el primer principio, nos queda∆U=Q , es decir, el calor es una función de estado. Esto significa que la única forma de variar la energía interna en un proceso en el que no se varía el volumen es a través del intercambio de calor
-
p = cte. Procesos isobáricos. Aquellos en los que
la presión permanece constante. Por ejemplo, las reacciones químicas. El
valor del trabajo se calcula a partir de la expresión
Wsistema=p⋅∆V óWsistema=−p⋅∆V , según criterio IUPAC o tradicional respectivamente
Por otro lado, este tipo de procesos permiten definir una nueva variable de estado, la entalpía H. De manera que:
Donde, como ves, la expresión de la entalpía no depende del criterio de signos seguido para llegar a ella∆U=Q+W∆U=Q−W}U2−U1=Q−p⋅(V2−V1)⇒⇒Q=U2+p⋅V2−(U1+p⋅V1)=H2−H1=∆H
-
T = cte. Procesos isotérmicos. Aquellos en los que
la temperatura permanece constante. Por ejemplo, un recipiente con gas y
un pistón en la zona superior, sumergido en un depósito calorífico a
temperatura constante. Al ser la temperatura constante, la variación de
energía interna es cero
∆U=0 y en consecuencia:
Donde se han tenido en cuenta los dos criterios de signos posibles. Observa que el proceso se realiza sobre una única isoterma:∆U=Q+W∆U=Q−W}0=Q+W0=Q−W}Q=−WQ=W}
El segundo principio de la termodinámica establece que, si bien todo el trabajo mecánico puede transformarse en calor, no todo el calor puede transformarse en trabajo mecánico. En este apartado estudiaremos:
- Si es posible convertir todo el trabajo en calor o todo el calor en trabajo
- El segundo principio de la termodinámica
- Su aplicación en el caso de las máquinas térmicas
- Qué entendemos por eficiencia o rendimiento de una máquina térmica
- Una introducción al concepto de entropía
- La relación que guardan la entropía y la tercera ley de la termodinámica
Restricciones a la primera ley
La primera ley de la termodinámica establece la relación que guardan el trabajo, el calor y la energía interna de un sistema según la expresión∆U=Q+W (ó∆U=Q−W , según criterio de signos elegido). Como vemos, a la luz del primer principio, siempre que se mantenga constante la energía interna de un sistema es posible transformar el trabajo en calor. También sería, en teoría, posible transformar todo el calor en trabajo. Sin embargo la experiencia nos dice que no es así.
La naturaleza impone una dirección en los procesos según la cual es posible transformar todo el trabajo de un sistema en calor pero es imposible transformar todo el calor que tiene en trabajo.Es por ello que resulta necesaria una segunda ley que establezca esta restricción que observamos en la naturaleza.
Segunda ley de la termodinámica
Al igual que ocurren con otras leyes de termodinámica, el segundo principio es de tipo empírico, llegamos a él a través de la experimentación. La termodinámica no se preocupa de demostrar por qué las cosas son así, y no de otra forma.
Observa que esta segunda ley no dice que no sea posible la extracción de calor de un foco frío a otro más caliente. Simplemente dice que dicho proceso nunca será espontáneo.La segunda ley de la termodinámica se expresa en varias formulaciones equivalentes:
Enunciado de Kelvin - Planck
No es posible un proceso que convierta todo el calor absorbido en trabajo.
Enunciado de Clausiois
No es posible ningún proceso cuyo único resultado sea la extracción de calor de un cuerpo frío a otro más caliente.
A continuación vamos a estudiar las consecuencias de estas leyes en el caso de máquinas térmicas y a introducir el concepto de entropía.
Máquinas térmicas
Las máquinas térmicas son sistemas que transforman calor en trabajo. En ellas, se refleja claramente las restricciones señaladas anteriormente. Existen muchos ejemplos de aparatos que son, en realidad, máquinas térmicas: la máquina de vapor, el motor de un coche, e incluso un refrigerador, que es una máquina térmica funcionando en sentido inverso.
Una máquina térmica transforma energía térmica en trabajo realizando un ciclo de manera continuada. En ellas no hay variación de energía interna,∆U=0 .Estructura
En la figura inferior puede verse un esquema de una máquina térmica habitual.
Dado que T1 > T2 , el calor fluye de manera espontánea desde la fuente al sumidero. La máquina transforma parte de este calor en trabajo, y el resto fluye al sumidero. No existe variación en la energía interna de la máquina resultando:
Donde hemos utilizado el valor absoluto para ser consistente con cualquiera de los criterios de signos habituales. Observa que, en condiciones óptimas:∆U=0⇒|Q1|=|W|+|Q2|
Es decir, no todo el calor que absorve la máquina se transforma en trabajo.|W|=|Q1|−|Q2|⇒|W|<|Q1|
Puede que te estés preguntando si sería posible otro modelo de máquina, sin sumidero de calor, que sí permita transformar todo el calor en trabajo. La respuesta es que una máquina así es imposible de construir en la práctica ya que se necesita de una diferencia de temperatura entre la fuente de calor y el sumidero para que este fluya a través de la máquina.

Funcionamiento
El proceso cíclico de una máquina térmica sigue los siguientes pasos:
- La fuente de calor, por ejemplo una caldera, a una temperatura T1 , inicia una transferencia del mismo Q1 a la máquina. Esta transferencia es posible por la diferencia de temperatura con el sumidero, a una temperatura T2
- La máquina emplea parte de ese calor en realizar el trabajo W . Por ejemplo, el movimiento de un pistón
- El resto de calor Q2 se transfiere a un sumidero de calor, por ejemplo un circuito de refrigeración, a una temperatura T2 < T1
Eficiencia térmica
Las máquinas térmicas aprovechan una parte del calor que reciben y lo transforman en trabajo, dejando el resto que pase al sumidero. Dadas dos máquinas cualesquiera, nos será útil saber cual de ellas es capaz de convertir en trabajo una mayor cantidad del calor que recibe.
El rendimiento o eficiencia térmica es la relación entre el trabajo realizado y el calor suministrado a la máquina en cada ciclo. Su expresión viene dada por:
Donde:
- η : Rendimiento o eficiencia térmica. Representa la parte de calor que la máquina aprovecha para realizar trabajo. Su valor se establece en tanto por uno ( η = 1 significa rendimiento del 100% )
- W : Trabajo realizado por la máquina. Su unidad de medida en el sistema internacional es el julio ( J )
- Q1 , Q2 : Calor. Representa el flujo de calor transferido entre la fuente y la máquina y la máquina y el sumidero respectivamente. Su unidad de medida en el sistema Internacional es el julio ( J ), aunque también se usa la caloría ( cal ). 1 cal = 4.184 jul
El hecho de que los valores de eficiencia sean menores del 100% no es una cuestión técnica que se pueda mejorar, sino una consecuencia del segundo principio de la termodinámica.

Entropía
El segundo principio de la termodinámica no se límita exclusivamente a máquinas térmicas sino que se ocupa, en general, de todos los procesos naturales que suceden de manera espontánea. Podemos decir que se ocupa de la evolución natural de los sistemas termodinámicos, es decir, de la dirección en que avanzan. Esta dirección se asocia a la distribución molecular interna de las moléculas.
Para estudiar la espontaneidad de los procesos, el austriaco Ludwig Edward Boltzmann introdujo una nueva magnitud denominada entropía.
Un estudio más exhaustivo de le entropía requiere herramientas matemáticas que están fuera del ámbito de este nivel educativo, sin embargo si es importante que sepas qué relación guarda la entropía con la segunda ley de la termodinámica.La entropía S es una variable de estado. Está asociada a la probabilidad de que un determinado estado ocurra en un sistema. Aquellos más probables tienen una mayor entropía.
Cualquier proceso natural espontáneo evoluciona hacia un aumento de la entropía.Veamos algunos ejemplos concretos para entender mejor este concepto:
- Si coges un montón de lápices y los lanzas al aire, cuando caigan es poco probable que caigan alineados. Lo más probable es que caigan en completo desorden
- Si echas azucar al agua, las partículas se distribuyen al azar por toda la disolución de un modo espontáneo, y no en una sola dirección
- En un gas que se expande libremente, la presión en las paredes del recinto en el que se encuentra es la misma en cualquier punto. La razón es que las partículas del gas se han expandido en todas direcciones por igual y no en una en concreto
Degradación energética
A partir de las leyes primera y segunda de la termodinámica podemos decir que en toda transformación natural la energía del universo se conserva y su entropía aumenta. Por tanto:
Este aumento de entropía se asocia a un aumento de la energía térmica de los sistemas. La energía térmica es la forma más degradada de energía, ya que, como hemos señalado, no se puede aprovechar íntegramente en producir trabajo. A este fenómeno se le ha venido a denominar crisis entrópica ya que conduce al universo, con el paso de millones de años, a una muerte térmica: todas las formas de energía se acabarán convirtiendo en calor.∆Uuniverso=0 ; ∆Suniverso=0
Tercera ley de la termodinámica
La entropía está intimamente relacionada con la tercera ley de la termodinámica, mucho menos importante que las otras dos. Fue desarrollada en 1906 por Walther Nernst y su estudio detallado queda fuera de los propósitos de este nivel. Sin embargo, si es importante que sepas que está relacionada con el comportamiento de la entropía cuando nos acercamos al cero absoluto.
La entropía de una sustancia pura y cristalina en el cero absoluto es nula.
y las respuestas?
ResponderBorrar